
Inhalt
- TL; DR (zu lang; nicht gelesen)
- Wie man Maulwürfe berechnet
- Umwandlung in Mmol
- Lösungskonzentration
- Beispiel
Um ihre Berechnungen zu vereinfachen, haben Chemiker eine Standardeinheit für die Anzahl der Atome einer bestimmten Verbindung erstellt, die an einer Reaktion oder einem anderen chemischen Prozess beteiligt ist. Sie definieren ein Mol (Mol) als die Menge einer Substanz, die die gleiche Anzahl von Grundeinheiten wie 12 Gramm Kohlenstoff-12 aufweist, was der Avogadros-Zahl (6,022 × 10) entspricht23). Das SI-System (metrisches System) definiert ein Millimol (Mmol) als ein Tausendstel eines Mols. In der Regel berechnen Sie die Anzahl der Mol eines Stoffes, indem Sie die Menge abwägen, die Ihnen zur Verfügung steht. Wenn Sie in Mmol konvertieren möchten, multiplizieren Sie mit 103 (1,000).
TL; DR (zu lang; nicht gelesen)
Ein Mol entspricht der Avogadros-Anzahl von Partikeln einer bestimmten Verbindung. Ein Millimol (Mmol) ist ein Tausendstel einer Mole.
Wie man Maulwürfe berechnet
Atommassen werden in Atommasseneinheiten (AMU) gemessen. Eine AMU ist genau 1/12 der Masse des Kerns eines Kohlenstoff-12-Atoms im Grundzustand. Ein Mol einer Substanz ist definiert als die Avogadros-Anzahl von Partikeln dieser Substanz. Nach dieser Definition entspricht das Gewicht eines Mols eines Stoffes in Gramm dem Gewicht eines einzelnen Teilchens dieses Stoffes in AMU. Beispielsweise beträgt das Atomgewicht von Kohlenstoff-12 12 AMU, sodass ein Mol Kohlenstoff-12 12 Gramm wiegt.
Stellen Sie sich einen Behälter mit Wasserstoffgas vor (H2). Jedes Teilchen im Behälter ist ein Molekül, das aus zwei Wasserstoffatomen besteht. Sie müssen also nur die Atommasse von Wasserstoff kennen, um das Molekulargewicht zu berechnen. Die meisten Versionen des Periodensystems listen die Atommasse jedes Elements unter seinem Symbol auf. Für Wasserstoff, der ein einzelnes Proton im Kern hat, ist dies 1.008 AMU, was einen Durchschnitt aller natürlich vorkommenden Isotope von Wasserstoff darstellt. Folglich beträgt die Atommasse von Wasserstoffgas 2,016 AMU, und ein Mol Wasserstoffgas wiegt 2,016 Gramm. Um die Anzahl der Mol in Ihrer Probe zu ermitteln, würden Sie die Probe in Gramm wiegen und dieses Gewicht durch das Molekulargewicht des Wasserstoffgases in Gramm dividieren. Beispielsweise enthält eine Probe mit einem Gewicht von 15 g reinem Wasserstoffgas 7,44 Mol.
Umwandlung in Mmol
Manchmal sind die untersuchten Mengen so gering, dass es umständlich ist, sie in Mol auszudrücken. Geben Sie das Millimol ein. Durch Multiplizieren der Molzahl mit Tausend können Sie eine sehr kleine Zahl in eine handlichere Zahl umwandeln. Dies ist besonders praktisch, wenn es sich um Volumeneinheiten in der Größenordnung von Millilitern handelt.
1 mol = 1000 mMol
Lösungskonzentration
Chemiker verwenden die Molarität als Maß für die Konzentration einer bestimmten Verbindung in Lösung. Sie definieren die Molarität als die Anzahl der Mol pro Liter. Sie konvertieren Molarität in Millimolarität, indem Sie mit 1.000 multiplizieren. Beispielsweise hat eine 1 mol (molar, auch als M bezeichnet) Lösung eine Konzentration von 1 mol pro Liter. Dies entspricht einer Lösung von 1.000 Mmol (millimolar, manchmal auch als mM bezeichnet), die 1.000 Mmol pro Liter enthält.
Beispiel
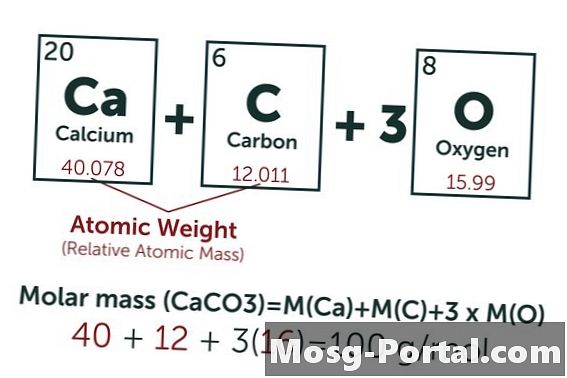
Eine Lösung enthält 0,15 g Calciumcarbonat. Wie viele Millimol sind das?
Die chemische Formel von Calciumcarbonat lautet CaCO3. Das Atomgewicht von Kohlenstoff (C) beträgt ungefähr 12 AMU, das von Sauerstoff (O) ungefähr 16 AMU und das von Calcium (Ca) ungefähr 40 AMU. Jedes Molekül Calciumcarbonat wiegt somit 100 AMU, was bedeutet, dass ein Mol ungefähr 100 Gramm wiegt. Ein Gewicht von 0,15 g bedeutet 0,15 g - 100 g / mol = 0,0015 mol. Dies entspricht 1,5 Mmol.
Was ist die Molarität und Millimolarität dieser Menge Calciumcarbonat in 2,5 Litern Lösung?
Die Molarität ist definiert als die Anzahl der Mol pro Liter. Teilen Sie die Anzahl der Mol durch 2,5, um die Molarität zu erhalten: 0,0015 15 2,5 =
0,0006 M
Mit 1.000 multiplizieren, um die Millimolarität = zu erhalten
0,6 mM
Beachten Sie, dass Sie dasselbe Ergebnis für die Millimolarität erhalten, wenn Sie die Anzahl der Millimole durch das Volumen der Lösung dividieren.