Inhalt
Die Siedepunkte von Substanzen variieren je nach ihrer Struktur auf molekularer Ebene. Kannten alle den Siedepunkt von Wasser bei Normaldruck - 100 Grad Celsius oder 212 Grad Fahrenheit. Viele der Substanzen, die Sie als Gase betrachten, sind jedoch nur Gase, da ihre Siedepunkte weit unter Raumtemperatur liegen. Sogar einige Substanzen, die bei Raumtemperatur flüssig sind, wie Ethanol, haben niedrigere Siedepunkte als Wasser.
Atmosphäre
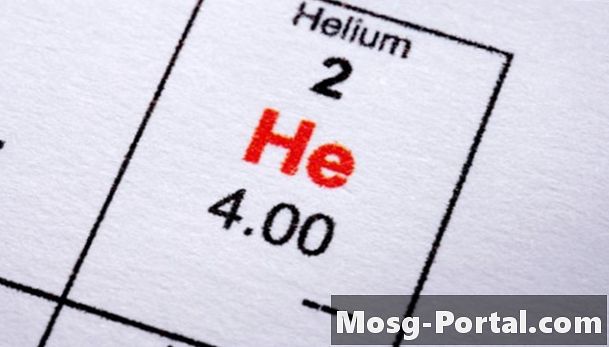
Stickstoff (N2), Kohlendioxid, Sauerstoff (O2), Helium, Chlor (Cl2) und Wasserstoff sind bekannte Beispiele für Substanzen, die bei viel niedrigeren Temperaturen als Wasser sieden. Flüssiges Helium hat den niedrigsten Siedepunkt von allen - etwa -452 Grad Fahrenheit, nur 4,2 Grad Celsius über dem absoluten Nullpunkt. Obwohl diese Substanzen Gase genannt werden, ist es wichtig zu bedenken, dass keine Substanz als "Gas" oder "Flüssigkeit" definiert werden kann, außer bei einer bestimmten Temperatur. Flüssigkeit, Feststoff und Gas sind nur verschiedene Materiezustände, und ein Stoff kann je nach Temperatur und Druck einen dieser drei Zustände einnehmen.
Unpolare Kohlenwasserstoffe
Wasser hat ein Dipolmoment, was bedeutet, dass es polar ist, weil Sauerstoff schwach negativ und Wasserstoff schwach positiv geladen ist. Kohlenwasserstoffverbindungen, wie sie in Benzin vorkommen, sind jedoch unpolar. Wechselwirkungen, die als Londoner Dispersionskräfte bezeichnet werden, halten unpolare Moleküle in der festen oder flüssigen Phase zusammen. Diese Londoner Kräfte werden mit zunehmender Größe der Moleküle stärker. Folglich sieden viele kleinere unpolare Moleküle wie die Komponenten von Benzin bei einer niedrigeren Temperatur als Wasser, weil die intermolekularen Wechselwirkungen schwächer sind.
Alkohole
Alkohole sind wie Wassermoleküle polar und können auch eine spezielle Art von Bindung bilden, die als Wasserstoffbindung bezeichnet wird. Wassermoleküle können jedoch zwei Wasserstoffbrückenbindungen bilden, während ein Alkohol nur eine bilden kann. Alkohole haben tendenziell einen höheren Siedepunkt als Kohlenwasserstoffe gleicher Größe, aber einen niedrigeren Siedepunkt als Wasser. So macht man Schnaps wie Whisky: durch Destillation den Ethanolgehalt erhöhen.
Andere Moleküle
Viele andere Moleküle haben niedrigere Siedepunkte als Wasser. Ein bemerkenswertes Beispiel ist eine Klasse von Molekülen, die Ether genannt werden und deren Sauerstoff an zwei Kohlenstoffe gebunden ist. Sie sind leicht polar, aber nicht so polar wie Wasser oder Alkohole und können keine Wasserstoffbrückenbindungen bilden. Daher haben sie typischerweise niedrigere Siedepunkte. Ein anderes Beispiel ist Ammoniak, das typischerweise in Wasser gelöst verkauft wird. Es siedet unter 0 Grad Celsius und wird bei Raumtemperatur als Gas gefunden, das sich jedoch leicht auflöst.