Inhalt
- Paramagnetische vs. diamagnetische Elemente
- Berechnen, ob ein Element paramagnetisch oder diamagnetisch ist
- Eine Liste paramagnetischer Atome
- Paramagnetische Verbindungen
Alle Atome reagieren in gewisser Weise auf Magnetfelder, aber sie reagieren je nach Konfiguration der Atome, die den Kern umgeben, unterschiedlich. Abhängig von dieser Konfiguration kann ein Element diamagnetisch, paramagnetisch oder ferromagnetisch sein. Diamagnetische Elemente - das sind bis zu einem gewissen Grad alle - werden von einem Magnetfeld schwach abgestoßen, während paramagnetische Elemente schwach angezogen werden und magnetisiert werden können. Ferromagnetische Materialien können auch magnetisiert werden, aber im Gegensatz zu paramagnetischen Elementen ist die Magnetisierung permanent. Sowohl der Paramagnetismus als auch der Ferromagnetismus sind stärker als der Diamagnetismus, sodass Elemente, die entweder einen Paramagnetismus oder einen Ferromagnetismus aufweisen, nicht mehr diamagnetisch sind.
Nur wenige Elemente sind bei Raumtemperatur ferromagnetisch. Dazu gehören Eisen (Fe), Nickel (Ni), Kobalt (Co), Gadolinium (Gd) und - wie Wissenschaftler kürzlich entdeckten - Ruthenium (Ru). Mit jedem dieser Metalle können Sie einen Permanentmagneten herstellen, indem Sie ihn einem Magnetfeld aussetzen. Die Liste der paramagnetischen Atome ist viel länger. Ein paramagnetisches Element wird bei Vorhandensein eines Magnetfelds magnetisch, verliert jedoch seine magnetischen Eigenschaften, sobald Sie das Feld entfernen. Der Grund für dieses Verhalten ist das Vorhandensein eines oder mehrerer ungepaarter Elektronen in der äußeren Orbitalschale.
Paramagnetische vs. diamagnetische Elemente
Eine der wichtigsten Entdeckungen der Wissenschaft in den letzten 200 Jahren ist die Vernetzung von Elektrizität und Magnetismus. Da jedes Atom eine Wolke negativ geladener Elektronen hat, hat es das Potenzial für magnetische Eigenschaften. Ob es jedoch Ferromagnetismus, Paramagnetismus oder Diamagnetismus aufweist, hängt von seiner Konfiguration ab. Um dies zu verstehen, ist es notwendig zu verstehen, wie Elektronen entscheiden, welche Bahnen um den Kern herum besetzt werden sollen.
Die Elektronen haben eine Eigenschaft, die man Spin nennt und die man sich als Drehrichtung vorstellen kann, obwohl sie komplizierter ist. Elektronen können "hochdrehen" (was Sie sich als Drehung im Uhrzeigersinn vorstellen können) oder "runterdrehen" (gegen den Uhrzeigersinn). Sie ordnen sich in zunehmenden, genau definierten Abständen vom Kern an, die als Schalen bezeichnet werden, und in jeder Schale befinden sich Unterschalen mit einer diskreten Anzahl von Orbitalen, die von maximal zwei Elektronen mit jeweils entgegengesetztem Spin besetzt werden können. Zwei Elektronen, die ein Orbital besetzen, sollen gepaart sein. Ihre Spins heben sich auf und sie erzeugen kein magnetisches Nettomoment. Ein einzelnes Elektron, das ein Orbital einnimmt, ist dagegen ungepaart und führt zu einem magnetischen Nettomoment.
Diamagnetische Elemente sind solche ohne ungepaarte Elektronen. Diese Elemente wirken einem Magnetfeld nur schwach entgegen, was Wissenschaftler häufig dadurch demonstrieren, dass sie ein diamagnetisches Material wie Pyrolith-Graphit oder einen Frosch (ja, einen Frosch!) Über einen starken Elektromagneten schweben lassen. Paramagnetische Elemente sind solche mit ungepaarten Elektronen. Sie geben dem Atom ein magnetisches Nettodipolmoment, und wenn ein Feld angelegt wird, richten sich die Atome mit dem Feld aus und das Element wird magnetisch. Wenn Sie das Feld entfernen, greift Wärmeenergie ein, um die Ausrichtung zu regeln, und der Magnetismus geht verloren.
Berechnen, ob ein Element paramagnetisch oder diamagnetisch ist
Elektronen füllen Hüllen um den Kern auf eine Weise, die die Nettoenergie minimiert. Wissenschaftler haben drei Regeln entdeckt, die sie dabei befolgen: das Aufbräu-Prinzip, die Hunds-Regel und das Pauli-Ausschlussprinzip. Anhand dieser Regeln können Chemiker bestimmen, wie viele Elektronen jede der einen Kern umgebenden Unterschalen besetzen.
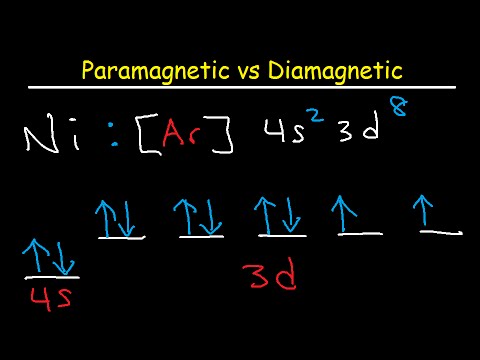
Um festzustellen, ob ein Element diamagnetisch oder paramagnetisch ist, müssen nur die Valenzelektronen betrachtet werden, die die äußerste Unterschale einnehmen. Wenn die äußerste Unterschale Orbitale mit ungepaarten Elektronen enthält, ist das Element paramagnetisch. Ansonsten ist es diamagnetisch. Wissenschaftler identifizieren die Unterschalen als s, p, d und f. Beim Schreiben der Elektronenkonfiguration ist es üblich, den Valenzelektronen das Edelgas voranzustellen, das dem betreffenden Element im Periodensystem vorausgeht. Edelgase haben Elektronenorbitale vollständig ausgefüllt, weshalb sie inert sind.
Beispielsweise beträgt die Elektronenkonfiguration für Magnesium (Mg) 3s2. Die äußerste Unterschale enthält zwei Elektronen, die jedoch ungepaart sind, sodass Magnesium paramagnetisch ist. Andererseits beträgt die Elektronenkonfiguration von Zink (Zn) 4s23d10. Es hat keine ungepaarten Elektronen in seiner äußeren Hülle, daher ist Zink diamagnetisch.
Eine Liste paramagnetischer Atome
Sie könnten die magnetischen Eigenschaften jedes Elements berechnen, indem Sie die Elektronenkonfigurationen aufschreiben, aber glücklicherweise müssen Sie das nicht. Chemiker haben bereits eine Tabelle paramagnetischer Elemente erstellt. Sie sind wie folgt:
Paramagnetische Verbindungen
Wenn sich Atome zu Verbindungen verbinden, können einige dieser Verbindungen aus dem gleichen Grund wie Elemente auch Paramagnetismus zeigen. Wenn ein oder mehrere ungepaarte Elektronen in den Orbitalen der Verbindungen vorhanden sind, ist die Verbindung paramagnetisch. Beispiele hierfür sind molekularer Sauerstoff (O2), Eisenoxid (FeO) und Stickoxid (NO). Im Falle von Sauerstoff ist es möglich, diesen Paramagnetismus mit einem starken Elektromagneten anzuzeigen. Wenn Sie flüssigen Sauerstoff zwischen die Pole eines solchen Magneten gießen, sammelt sich der Sauerstoff um die Pole, während er verdampft und eine Sauerstoffgaswolke erzeugt. Versuchen Sie dasselbe Experiment mit flüssigem Stickstoff (N2), die nicht paramagnetisch ist und keine solche Wolke bilden wird.
Wenn Sie eine Liste paramagnetischer Verbindungen erstellen möchten, müssen Sie die Elektronenkonfigurationen untersuchen. Da es sich um ungepaarte Elektronen in den äußeren Valenzschalen handelt, die paramagnetische Eigenschaften verleihen, sollten Verbindungen mit solchen Elektronen auf die Liste gesetzt werden. Dies ist jedoch nicht immer der Fall. Im Fall des Sauerstoffmoleküls gibt es eine gerade Anzahl von Valenzelektronen, die jedoch jeweils einen niedrigeren Energiezustand einnehmen, um den Gesamtenergiezustand des Moleküls zu minimieren. Anstelle eines Elektronenpaares in einem höheren Orbital gibt es zwei ungepaarte Elektronen in niedrigeren Orbitalen, wodurch das Molekül paramagnetisch wird.